斑马鱼能让人视网膜修复手术迎来新曙光?
不同物种的视网膜再生能力不同。斑马鱼能通过重编程米勒胶质细胞(Müller glia, MG)实现视网膜损伤的完全修复,重编程米勒胶质细胞对视网膜损伤做出反应,分裂并产生多能的视网膜祖细胞,负责主要的视网膜神经元类型再生。鸟类中的小鸡有部分视网膜损伤修复能力,但哺乳动物并不能自动修复损伤的视网膜。
目前虽已知部分调控视网膜再生的转录因子,但控制米勒细胞重编程实现视网膜再生的核心调控网络仍并不清楚。鱼类和哺乳动物的视网膜是由具有保守功能的相似细胞类型组成的。因此,鱼类视网膜再生的研究可能为刺激哺乳动物视网膜再生提供策略。
视网膜位于眼睛的后部,是中枢神经系统中相对简单和容易接近的部分,由六种神经细胞类型和一种胶质细胞类型组成,它们被分成三层不同的神经细胞:光检测感受细胞、信号集合水平细胞和传递信息到大脑的神经节细胞(图1),这与人类的视网膜的细胞组织几乎一致。由于这种相对简单的组成以及视网膜实验操作的可及性,使斑马鱼可作为研究中枢神经系统一个重要的实验系统【1】。
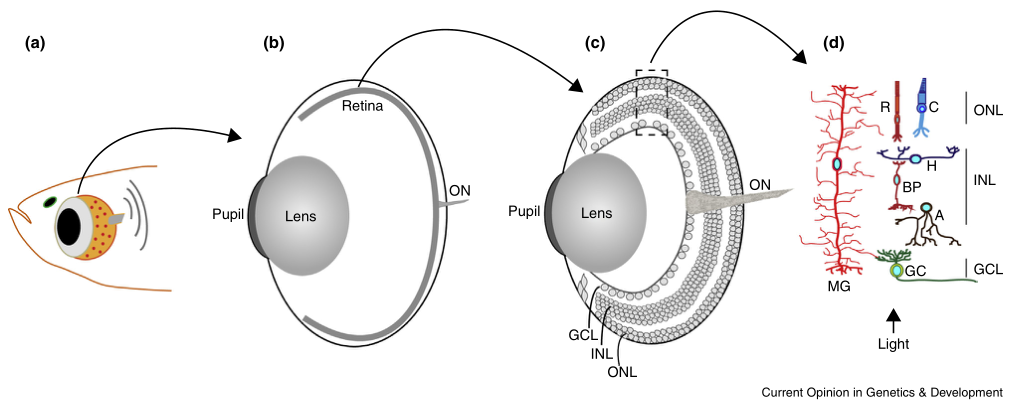
图1 斑马鱼视网膜解剖图
(a) 鱼头及鱼眼示意图。
(b) 鱼眼示意图,视网膜为排列在眼睛后部的一层薄组织,视神经由视网膜神经节细胞发出的轴突组成。
(c) 视网膜放大图,显示视网膜的不同层。视网膜被组织成三个核层(ONL、INL和GCL),它们被突触层分开。
(d) 视网膜的神经元和神经胶质。
缩写
米勒胶质细胞Müller glia (MG)
外核层outer nuclear layer (ONL)
内核层 inner nuclear layer(INL)
神经节细胞层ganglion cell layer(GCL)
胶质纤维酸性蛋白 glial fibrillary acidic protein(Gfap)
中枢神经系统central nervous system (CNS)
视神经optic nerve (ON)
神经节细胞ganglion cells (GC)
神经节细胞层(GCL)
杆状Rod (R)
锥状 cone(C)
水平神经胶质细胞horizontal (H)
双极性神经胶质细胞bipolar (BP)
无长突神经胶质细胞amacrine (A)
米勒胶质细胞是视网膜中主要的胶质细胞类型,呈放射状形态,其胞体和核位于视网膜的内核层(inner nuclear layer, INL),并向外和内视网膜限制膜延伸突起(图1)。这种胶质细胞结构使它们能够参与视网膜结构并监测视网膜环境,参与视网膜稳态调控和神经保护。
米勒胶质细胞及其在受损视网膜中的行为
米勒胶质细胞通过过度分裂和细胞骨架基因激活响应视网膜损伤,如胶质纤维酸性蛋白(glialfibrillary acidic protein, Gfap)和波形蛋白。米勒胶质细胞在哺乳动物视网膜损伤后几乎很少分裂,一旦分裂,通常会导致纤维化和胶质瘢痕。
鱼类胶质细胞获得干细胞特性,与胶质细胞增殖和视网膜祖细胞产生前基因表达的大规模变化有关,这些基因表达的变化伴随着斑马鱼基因组的部分重编程,特征是DNA甲基化的变化和与多能性相关的基因激活,损伤反应性神经胶质细胞的重编程细胞核从INL迁移到外核层(outer nuclear layer, ONL),并开始不对称分裂,然后返回到INL,这一过程称为动力间胞核移行。这种不对称的分裂导致视网膜祖细胞的产生,当它以Pax6依赖方式扩增时,少量的祖细胞能够再生所有主要的视网膜神经元类型,表现出动力间胞核移行(图2)。
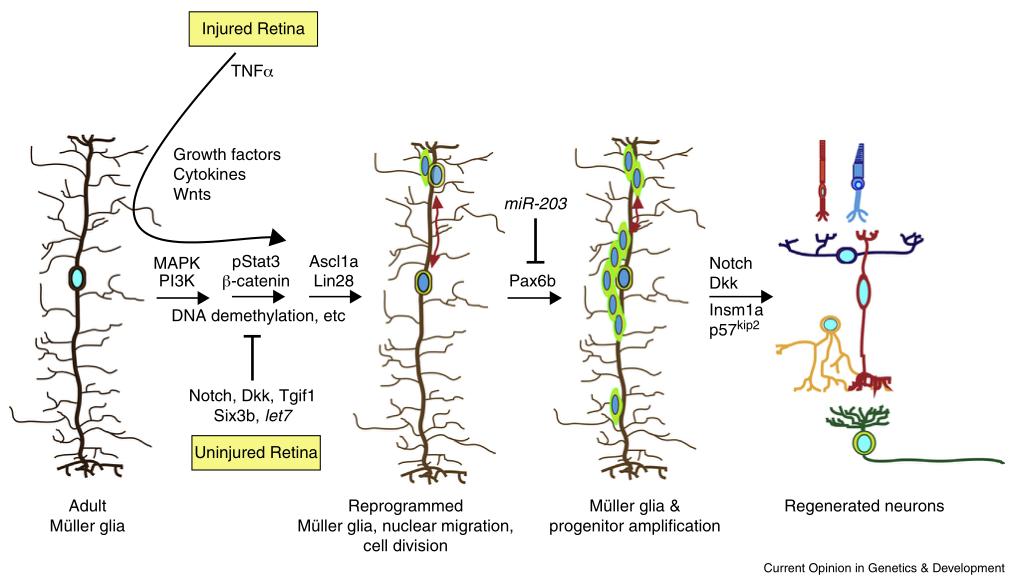
图2 调节米勒胶质细胞重编程和视网膜再生的信号通路
米勒胶质细胞重编程和视网膜再生的信号机制
视网膜再生是由死亡细胞启动,这些细胞可能通过分泌因子或通过扰乱它们与米勒胶质细胞的互作来传递信息。在适当条件下,编码生长因子和细胞因子的基因可在损伤的斑马鱼视网膜中被诱导,并刺激米勒胶质细胞的增殖(图2)。这些因子都通过米勒胶质祖细胞表达,因此它们可能以自分泌或旁分泌的方式刺激米勒胶质细胞和其祖细胞增殖。
在已知影响米勒胶质细胞增殖的所有分泌因子中,TNFα是唯一一种由死亡细胞表达的因子,它可能是一种将细胞死亡信息传达给胶质细胞的信号。但它并不总是与死亡的米勒胶质细胞有关,并且对米勒胶质细胞增殖的影响非常小。
Notch信号通路可显著增强受损视网膜中的米勒胶质细胞增殖,由MAPK依赖途径。在未损伤的视网膜中,Notch抑制联合TNFα可刺激米勒胶质细胞增殖和神经发生能力。受损视网膜中最早调控的信号通路是MAPK和PI3K信号通路,这也是胶质细胞增殖所必需的(图2)。
外部信号调节米勒胶质祖细胞
视网膜随着鱼的生长而发育,视网膜扩张是由位于睫状体边缘的神经上皮祖细胞向视网膜周围生发区播散的新神经元启动的(图3)。这些祖细胞可分裂为的所有主要视网膜细胞类型,除杆状细胞。杆状细胞是在ONL中的杆状祖细胞发育的,此外在未损伤的视网膜中,米勒胶质细胞也是单能干细胞的来源,在视网膜发育过程中,这些单能干细胞负责在ONL产生杆状细胞【2】。
TNFα 和 leptin 等生长因子和细胞因子,在损伤反应的米勒胶质细胞中被诱导,并刺激未损伤视网膜的米勒胶质细胞分裂并产生多功能祖细胞,这些因子可能是视网膜损伤环境的组成部分,有助于多能性祖细胞的产生。
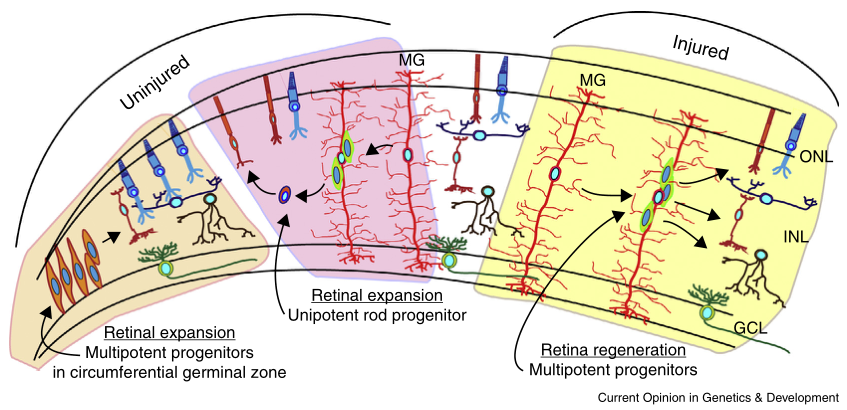
图3 视网膜祖细胞
斑马鱼视网膜为研究人类视网膜再生提供了一个理想的模型。对视网膜再生机制的研究揭示了基因表达程序和信号通路在这一过程中所起的重要作用,但仍然有许多未解的问题需进一步验证,如所有的米勒胶质细胞产生祖细胞的特性是否都相同、视网膜损伤的死细胞如何与米勒胶质细胞交流以刺激它们的重新编程和增殖等。
[1] Wan J, Goldman D. Retina regeneration in zebrafish. Curr Opin Genet Dev. 2016 Oct;40:41-47.
[2]Hoang T, Wang J, Boyd P, et al. Gene regulatory networks controlling vertebrate retinal regeneration. Science. 2020;370(6519):eabb8598.



